¿"Qué son las "Partículas Subatómicas"?
En la Grecia clásica, un átomo era concebido como la parte mas pequeña e indivisible constituyente de la materia. Posteriormente la electroquímica liderada por G. Johnstone Stoney, dio lugar al descubrimiento de los electrones (e-) en 1874, si embargo el siguiente avance ocurrido fue realizado por Albert Einsten, cuando descubre la existencia real del "Fotón".
En 1987, Joseph John Thomson descubre el electrón.
Desarrollo del descubrimiento del Numero Subatómico.
En 1907 los experimentos de Ernest Rutherford revelaron que gran parte del átomo era realmente vacío, que casi toda la masa se concentraba en un núcleo pequeño.
James Chadwick descubrió el "Neutrón".
Wolfgang Pauling postulo en 1931 la existencia del neutrino y Enrico Ferri fue quien invento el nombre.
La confirmación de la existencia de los bosones en la década de los 80 y la verificación de sus propiedades en los 90.
Partículas Subatómicas
Materias de Estudio
Partículas Subatómicas
Partículas Subatómicas Clasificación - Elemental y Compuesta
Partículas subatómicas compuestas
Como hemos dicho, las partículas compuestas son las entidades subatómicas que fueron descubiertas primero. Y durante mucho tiempo (no fue hasta mediados del siglo XX que se teorizó la existencia de otras) se creyó que eran las únicas. Sea como sea, estas partículas subatómicas están formadas por la unión de las partículas elementales que veremos en el siguiente punto.
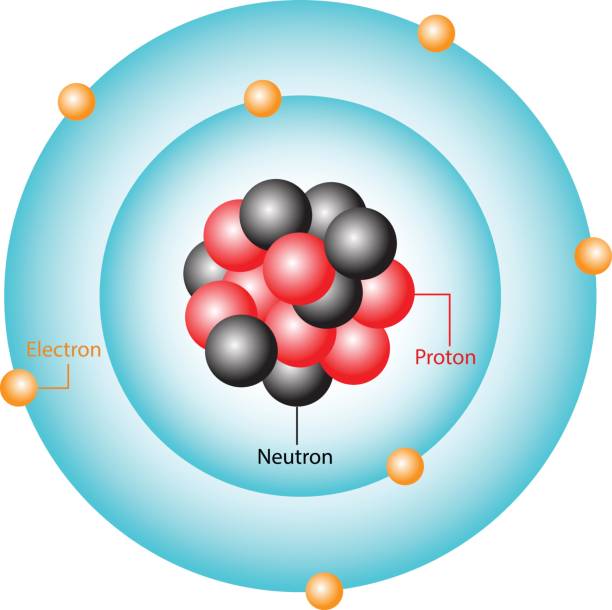
1. Protón
Como bien sabemos, un átomo está formado por un núcleo de protones y neutrones y una órbita de electrones que giran a su alrededor. El protón es una partícula subatómica con carga eléctrica positiva muchísimo más grande que el electrón. De hecho, tiene una masa 2.000 veces mayor.
Cabe destacar que la cantidad de protones es lo que determina el elemento químico. Así, un átomo de hidrógeno es aquel que tiene siempre un protón. Uno de oxígeno, ocho. Uno de hierro, 26. Y así sucesivamente.Partículas subatómicas elementales.
Las partículas elementales son aquellas que no se forman por la unión de varias partículas subatómicas. Son lo que tradicionalmente conocemos simplemente como “partículas subatómicas”. Veámoslas.
2. Electrón
El electrón ya es una partícula subatómica como tal, pues esta puede existir independientemente del átomo y, además, no está formado por la unión de otras partículas. Se trata de una partícula 2.000 veces más pequeña que un protón y tiene carga eléctrica negativa. De hecho, es la unidad cargada eléctricamente más pequeña de la naturaleza.
Estructura de las Partículas Subatómicas. - Up
- Up - Down
- Beauty
- Top
- Strange
- Charm
NÚMERO ATÓMICO Y NÚMERO DE MASA.
ISÓTOPOS
PESO ATÓMICO
• Es el promedio de las masas expresado en uma (Unidades de Masa Atómica).




El átomo es la unidad más pequeña posible de un elemento químico que conserva
ResponderEliminarsus propiedades, en la filosofía griega, la palabra "átomo" se empleaba para referirse
a la parte de materia más pequeño que podía concebirse. Esa "partícula
fundamental", se consideraba indestructible. De hecho, átomo significa en griego "no
divisible". El conocimiento sobre los aspectos más importantes de los átomos como su
tamaño y su naturaleza avanzó muy lentamente a lo largo de los siglos ya que la gente
por lo general, se limitaba a especular sobre él.
Con la estructuración de las ciencias experimentales a partir del siglo XVI los avances
en la teoría atómica se hicieron más rápidos. Los científicos se dieron cuenta muy
pronto de que todos los líquidos, gases y sólidos pueden descomponerse en sus
constituyentes últimos, o elementos. Por ejemplo, se descubrió que el aire, es una
mezcla de los gases nitrógeno, oxígeno y otros.